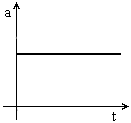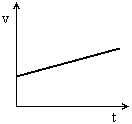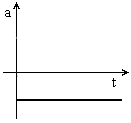Campo Grande,03 de Outubro de 2012
Nome:Paula Agostinho Nº27
Turma:9ºB Prof:Carol
Matéria:Ciências Aquecimento Global
Aquecimento global é o aumento da temperatura média dos oceanos e do ar perto da superfície da Terra que ocorre desde meados do século XX e que deverá continuar no século XXI. Segundo o Quarto Relatório de Avaliação do Painel Intergovernamental sobre Mudanças Climáticas (2007), a temperatura na superfície terrestre aumentou 0,74 ± 0,18 °C durante o século XX.
A maior parte do aumento de temperatura observado desde meados do século XX foi causada por concentrações crescentes de gases do efeito estufa, como resultado de atividades humanas como a queima de combustíveis fósseis e a desflorestação. O escurecimento global, uma consequência do aumento das concentrações de aerossois
atmosféricos que bloqueiam parte da radiação solar antes que esta
atinja a superfície da Terra, mascarou parcialmente os efeitos do
aquecimento induzido pelos gases de efeito de estufa.
Modelos climáticos referenciados pelo IPCC projetam que as
temperaturas globais de superfície provavelmente aumentarão no intervalo
entre 1,1 e 6,4 °C entre 1990 e 2100.
A variação dos valores reflete o uso de diferentes cenários de futura
emissão de gases estufa e resultados de modelos com diferenças na
sensibilidade climática. Apesar de a maioria dos estudos ter seu foco no
período até o ano 2100, espera-se que o aquecimento e o aumento no
nível do mar continuem por mais de um milênio, mesmo que as
concentrações de gases estufa se estabilizem.
Um aumento nas temperaturas globais pode, em contrapartida, causar
outras alterações, incluindo aumento no nível do mar, mudanças em
padrões de precipitação resultando em enchentes e secas. Espera-se que o aquecimento seja mais intenso no Ártico, e estaria associado ao recuo das geleiras, permafrost e gelo marinho.
Outros efeitos prováveis incluem alterações na frequência e intensidade
de eventos meteorológicos extremos, extinção de espécies e variações na
produção agrícola. O aquecimento e as suas consequências variarão de
região para região, apesar da natureza destas variações regionais ser
incerta. Outra ocorrência global concomitante com o aquecimento global que já se verifica e que se prevê continuar no futuro, é a acidificação oceânica, que é também resultado do aumento contemporâneo da concentração de dióxido de carbono atmosférico.
O consenso científico é que o aquecimento global antropogênico está a acontecer.O Protocolo de Quioto visa a estabilização da concentração de gases de efeito estufa para evitar uma "interferência antropogénica perigosa.Em Novembro de 2009 eram 187 os estados que assinaram e ratificaram o protocolo.
Efeito Estufa
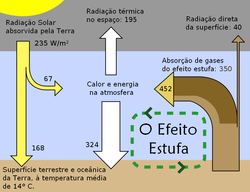
Uma representação esquemática das trocas de energia entre o espaço sideral, a atmosfera e a superfície da Terra. A capacidade da atmosfera terrestre para captar e reciclar energia emitida pela superfície do planeta é a característica do efeito de estufa.
O efeito estufa ou efeito de estufa é um processo que ocorre quando uma parte da radiação infravermelha emitida pela superfície terrestre é absorvida por determinados gases presentes na atmosfera. Como consequência disso, o calor fica retido, não sendo libertado para o espaço. O efeito estufa dentro de uma determinada faixa é de vital importância pois, sem ele, a vida como a conhecemos não poderia existir. Serve para manter o planeta aquecido, e assim, garantir a manutenção da vida.
O que se pode tornar catastrófico é a ocorrência de um agravamento do
efeito estufa que destabilize o equilíbrio energético no planeta e
origine um fenómeno conhecido como aquecimento global. O IPCC (Painel Intergovernamental para as Mudanças Climáticas, estabelecido pelas Organização das Nações Unidas e pela Organização Meteorológica Mundial em 1988) no seu relatório mais recente, diz que a maior parte deste aquecimento,observado durante os últimos 50 anos, se deve muito provavelmente a um aumento dos gases do efeito estufa.
Os gases de estufa (dióxido de carbono (CO2), metano (CH4), Óxido nitroso (N2O), CFC´s (CFxClx) absorvem alguma radiação infravermelha
emitida pela superfície da Terra e radiam por sua vez alguma da energia
absorvida de volta para a superfície. Como resultado, a superfície
recebe quase o dobro de energia da atmosfera do que a que recebe do Sol e a superfície fica cerca de 30 °C mais quente do que estaria sem a presença dos gases «de estufa».
Um dos piores gases é o metano, cerca de 20 vezes mais potente que o dióxido de carbono, é produzido pela flatulência dos ovinos e bovinos, sendo que a pecuária representa 16% da poluição mundial. Cientistas procuram a solução para esse problema e estão desenvolvendo um remédio para tentar resolver o caso. Na Nova Zelândia pensou-se em cobrar-se taxas por vaca, para compensar o efeito dos gases emitidos.
Ao contrário do significado literal da expressão «efeito estufa», a atmosfera terrestre não se comporta como uma estufa (ou como um cobertor). Numa estufa, o aquecimento dá-se essencialmente porque a convecção
é suprimida. Não há troca de ar entre o interior e o exterior. Já no
efeito estufa atmosférico, parte da radiação infravermelha emitida pela
superfície é absorvida pela atmosfera, aumentando sua temperatura, e
parte é re-emitida em processo sucessivo que, ao final, termina com sua
liberação para o espaço. Embora a temperatura aumente em ambos os casos,
os processos físicos são bastante distintos.
A energia recebida pelo sol tem espectro de frequência diferente
daquela emitida pela superfície terrestre. Os gases estufa são
largamente transparentes à luz solar visível, e obstruem o infravermelho
da Terra, retendo energia em nosso planeta.
O problema do aumento dos gases estufa e sua influência no
aquecimento global, tem colocado em confronto forças sociais que não
permitem que se trate deste assunto do ponto de vista estritamente
científico. Alinham-se, de um lado, os defensores das causas
antropogênicas como principais responsáveis pelo aquecimento acelerado
do planeta. São a maioria e omnipresentes na mídia. Do outro lado estão os "céticos", que afirmam que o aquecimento acelerado está muito mais relacionado com causas intrínsecas da dinâmica da Terra, do que com os reclamados desmatamento e poluição
que mais rápido causam os efeitos indesejáveis à vida sobre a face
terrestre do que propriamente a capacidade de reposição planetária.
Ambos os lados apresentam argumentos e são apoiados por forças sociais.
A poluição dos últimos duzentos anos tornou mais espessa a camada de
gases existentes na atmosfera. Essa camada impede a dispersão da energia
luminosa proveniente do Sol, que aquece e ilumina a Terra e também
retém a radiação infravermelha (calor) emitida pela superfície do
planeta. O efeito do espessamento da camada gasosa é semelhante ao de
uma estufa de vidro para plantas, o que originou seu nome. Muitos desses
gases são produzidos naturalmente, como resultado de erupções vulcânicas, da decomposição de matéria orgânica
e da fumaça de grandes incêndios. Sua existência é indispensável para a
existência de vida no planeta, mas a densidade atual da camada gasosa é
devida, em grande medida, à atividade humana. Em escala global, o
aumento exagerado dos gases responsáveis pelo efeito estufa provoca o
aquecimento do global, o que tem consequências catastróficas. O
derretimento das calotas polares, dos chamados "gelos eternos" e de geleiras, por exemplo, eleva o nível das águas dos oceanos e dos lagos, submergindo ilhas e amplas áreas litorâneas densamente povoadas. O super aquecimento das regiões tropicais e subtropicais contribui para intensificar o processo de desertificação e de proliferação de insetos nocivos à saúde humana e animal. A destruição de habitats naturais provoca o desaparecimento de espécies vegetais e animais. Multiplicam-se as secas, inundações e furacões, com sua sequela de destruição e morte.
Toda a absorção da radiação terrestre acontecerá próximo à superfície, isto é, nas partes inferiores da atmosfera, onde ela é mais densa, pois em maiores altitudes a densidade da atmosfera é baixa demais para ter um papel importante como absorvedor de radiação (exceto pelo caso do ozono). O vapor de água,
que é o mais poderoso dos gases estufa, está presente nas partes
inferiores da atmosfera, e desta forma a maior parte da absorção da
radiação se dará na sua base. O aumento dos gases estufa na atmosfera,
mantida a quantidade de radiação solar que entra no planeta, fará com
que a temperatura aumente nas suas partes mais baixas. O resultado deste processo é o aumento da radiação infravermelha
da base da atmosfera, tanto para cima como para baixo. Como a parte
inferior (maior quantidade de matéria) aumenta mais de temperatura que o
topo, a manutenção do balanço energético (o que entra deve ser igual ao
que sai) dá-se pela redistribuição de temperaturas da atmosfera terrestre.
Os níveis inferiores ficam mais quentes e os superiores mais frios. A
irradiação para o espaço exterior se dará em níveis mais altos com uma
temperatura equivalente a de um corpo negro irradiante, necessária para manter o balanço energético em equilíbrio.
As avaliações do Intergovernmental Panel on Climate Change (IPCC) são os mais completos resumos do estado da arte nas previsões do futuro do planeta, considerando vários cenários possíveis.


 , quando nesse mesmo referencial o ponto se move com módulo da
, quando nesse mesmo referencial o ponto se move com módulo da  , v é diferente de zero. Então, de acordo com um referencial:
, v é diferente de zero. Então, de acordo com um referencial: temos MU PROGRESSIVO
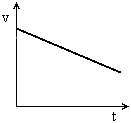
temos MU PROGRESSIVO temos MU RETRÓGRADO ou REGRESSIVO
temos MU RETRÓGRADO ou REGRESSIVO for o
for o  representar o
representar o  ou seja, a
ou seja, a  , i.e., a aceleração é nula.
, i.e., a aceleração é nula.